随着人类寿命的持续增加和老龄化社会的到来,老年人群所面临的慢性疾病问题日益受到社会的广泛关注。年龄的增长,骨骼肌遭受质量和功能上的减退,这种退化又称为老年性肌肉减少症(Sarcopenia),严重影响了老年人的生活质量。老年性肌少症不仅极大地增加了个体的残疾风险,而且在老年人身体机能的快速下降过程中发挥着不容忽视的作用。特别是对于那些超过80岁的高龄人群。然而,老年性肌少症的细胞生物学基础尚未完全阐明。
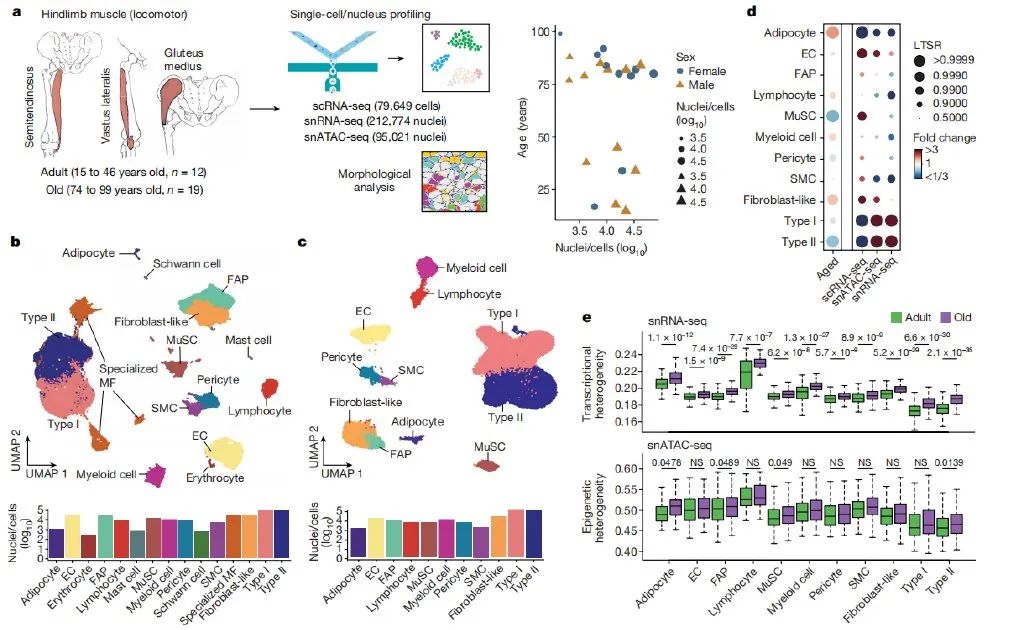
2024年4月22日,华大生命科学研究院联合西班牙庞培法布拉大学、广东药科大学第一附属医院、Altos Labs等国内外研究团队在 Nature 期刊发表了题为:Multimodal cell atlas of the ageing human skeletal muscle 的研究论文。研究人员收集了来自西班牙和中国的31位参与者的下肢肌肉活检,对整个样品进行了单核RNA测序(snRNA-seq)和染色质转座酶可及性测序(snATAC-seq)分析,并对分离的单核细胞进行了单细胞 RNA 测序 (scRNA-seq),得到的整个数据集包含22个个体的387,444个细胞核/细胞。
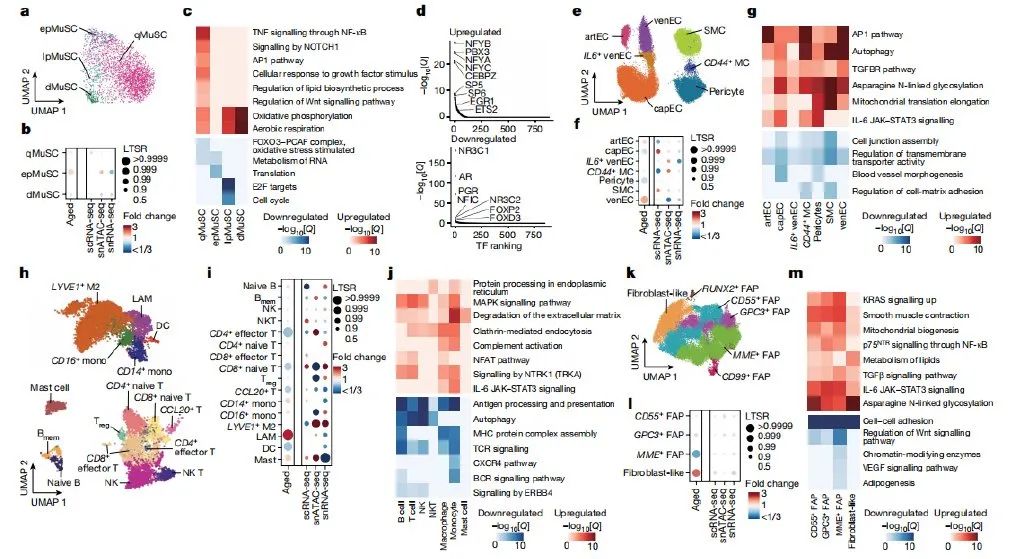
通过对数据集进行一系列分析,详细描述了细胞的类型以及根据临床条件变化而出现的细胞比例变化。在细胞衰老过程中,肌核(特别是II型肌纤维、MuSCs和周细胞)减少,脂肪细胞、成纤维细胞样细胞和免疫细胞增加。值得注意的是,研究人员注意到多数细胞类型在单个细胞/细胞核之间表现出增加的转录异质性,这是衰老的一个新特征,表观遗传不稳定性的增加可能促进细胞身份漂移。研究结果表明,衰老导致肌纤维成分和肌核特性发生显著变化,包括特定肌核类型的减少和新型肌核的出现,以及基因程序和调控网络的普遍或特定改变。其中II型肌纤维 (快纤维) 丢失,而I型肌纤维(慢纤维)则维持相对稳定;以及发现修复型(ID1+, DCLK1+ 肌核)和退变型肌纤维亚型(TNNT2+和 SAA2+)等新型肌纤维亚型在衰老中的涌现,并最终借助染色质开放组学数据构建了肌纤维衰老的基因调控网络。这些变化可能代表了机体对衰老的补偿机制,也可能是老年性肌少症发生的潜在因素。在肌纤维附近,肌肉还含有多种单核细胞,包括肌肉干细胞,成纤维/成脂肪祖细胞(FAP)、内皮细胞和免疫细胞。在肌肉损伤时,肌肉干细胞被激活,退出静止状态,并开始增殖,分化为肌细胞,并相互融合或与现有的肌纤维融合,以修复受损的肌肉。研究人员通过单细胞核转录组测序发现,静息态肌肉干细胞在衰老肌肉中减少,而始发态肌肉干细胞增加(FOS+),导致它们无法有效增殖和分化,这也可能是衰老中肌肉干细胞耗竭的机制之一。衰老过程中,内皮细胞发生了明显改变,促炎和趋化信号增加,而免疫细胞数量增多并启动炎症程序。此外,成纤维/成脂肪祖细胞群体在衰老过程中从促进再生的表型转变为促进纤维化的表型,并伴随着成熟脂肪细胞数量的增加。这些变化可能使肌肉在遭受明显损伤时更容易发生细胞衰老,并可能促进全身性炎症和加速老年人整体身体功能的衰退。研究人员还探索了肌肉微环境通讯的衰老差异,发现随着年龄的增长,单核细胞间的配体-受体相互作用显著增加。这些交流的增强可能与老年肌肉中的炎症、细胞外基质(ECM)沉积和多种信号通路失调有关。特别是,老年肌肉中FAPs特性的转变可能ECM的过度沉积有关,这导致了肌肉功能的损害。此外研究人员还发现了促肌萎缩TGF。
研究人员表示,他们的人类骨骼肌老化的参考图谱为老年人肌肉减少症和虚弱发展的增加提供了一系列令人信服的综合细胞和分子解释。可以为减缓甚至阻止老年人的肌肉减少症、虚弱和残疾提供一个机会之窗,促进更健康的身体衰老和延长寿命。除了衰老领域外,该图谱还将为未来神经肌肉疾病患者的研究提供重要参考。