江湖论剑:MSC的功能特性和临床挑战
路在脚下延伸,每前进一步都距离真理更近一步。温故而知新,今天了解一下关于MSCs的功能特性和临床挑战!这些都是值得思考的问题。
撰文:东海先生
首发:间充质干细胞
间充质干细胞(MSC)在临床上的应用越来越受到重视。然而,目前临床试验的绝大多数结果都不能满足医疗需求。与胚胎干细胞以及诱导多能干细胞和造血干细胞不同,MSC具有自己独特的功能特征。因此,与治疗相关的MSC生物学特性的一些问题需要在未来的临床应用中进行深入探讨。
在这一视角下,我们重点研究了MSC的基本和重要的生物学特性,然后分析了MSC的临床应用。我们试图为MSC治疗策略的优化提供合理的解释,以改进治疗。
1
MSC的功能性
基于三个功能特性:体外具有多项分化潜能、免疫调节作用(低免疫原性)、促进组织器官的修复,MSC备受临床医生和科学家的关注。
近的20年涌现出了大量的基础研究和临床研究的科研成果,欧盟、日本、加拿大、新西兰、韩国、我国台湾等国家地区都批准MSC为干细胞药品上市。干细胞疗法曾被视为万能药(cure-all)[1]。理论上, 胚胎干细胞(ESC)和诱导多能干细胞(iPS)可能是万能药,但是MSC肯定不是。然而,由于细胞生物学和传统药理学之间的差异,MSC作为药物面临着巨大的临床挑战,必须在临床上证明自己的疗效[2]。近,一篇综述讨论了培养基、细胞来源、培养环境和存储方式的选择对MSC产品的表型和临床用途的影响,明确提出细胞质量和细胞数量是MSC临床应用的两大关键因素[3]。
本文结合MSC的功能特性,深入分析MSC疗法的机理和可能影响因素,试图为MSC治疗策略的优化提供合理的解释,以改进治疗。
2
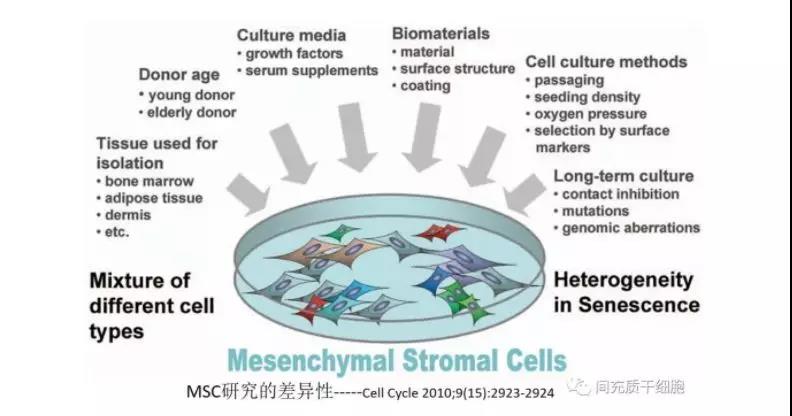
MSC的异质性
MSC存在于多种组织中,包括骨髓(BM)、脂肪(AD)、脐带血(UBC)、脐带(UC)、羊膜(AM)和牙髓(DP)。基本上,来自不同组织来源的MSCs共享相同的细胞表面标记[4]和三项分化能力[5]。虽然它们具有相同的基本功能特征,但它们之间的功能强度仍存在差异,如细胞大小、增殖潜能、分泌的细胞因子和免疫抑制能力。
3
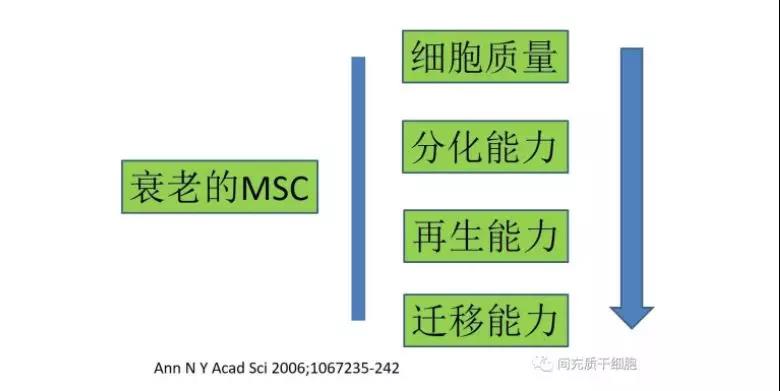
MSC的衰老
MSC在长期培养过程中出现衰老,随后改变其代谢特征[28, 48],这种代谢特征的改变与线粒体融合和裂变事件相关[28, 49, 50]。复制次数的增多,常常伴随着衰老过程中的遗传损伤的积累增多[51],减弱了干细胞的可用性和功能[52]。需要注意的是,因为接种起始MSC细胞浓度不一样,即使经过相同的扩增代数,细胞的复制周期是不一致的。复制性衰老与复制周期相关,而和代数的关系没那么大。细胞核型分析显示,骨髓MSC在第18代时发生染色体异常和端粒酶缩短[53],而脐带MSC在30代之前保持染色体稳定[54]。然而,也有研究显示人类MSC似乎是遗传稳定的,在长期培养后没有显示染色体异常,并且不具有致瘤性[53, 55]。有趣的是,由天然修复蛋白质组成的血小板裂解物能支持人骨髓MSC的长期培养扩增,具有稳定染色体的作用[56]。
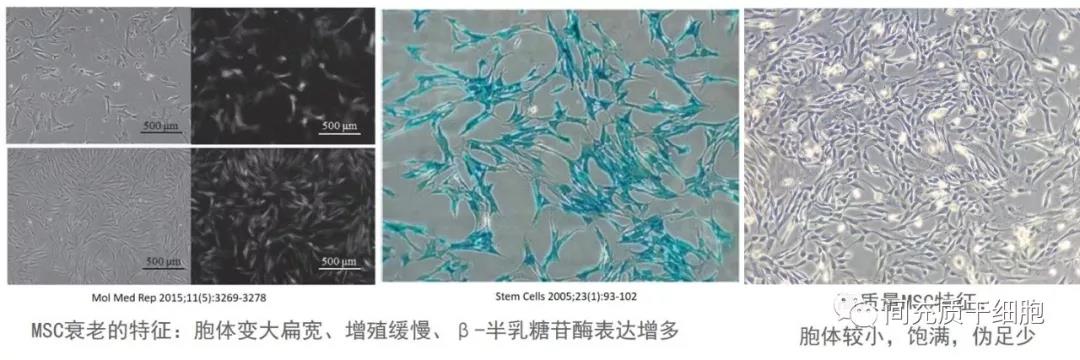
经过长期的细胞培养,骨髓MSC出现复制性衰老的表现是低增殖率,衰老相关的β-半乳糖苷酶出现高活性,DNA修复和抗氧化能力降低,p53和p16的表达增强[57]。p16INK4a的表达和β-半乳糖苷酶的活性与细胞面积有很强的相关性,第5代的人骨髓MSC的面积是第1代的4.8倍[58]。这些发现可用于开发基于非侵入性成像的新方法,以筛选和定量临床级细胞培养中的老化[58]。然而,另一项实验表明,p53和p16基因的表达在第15代中没有明显变化[59]。高代数的MSC也表现出p21的表达增加[60],p21是细胞周期蛋白依赖性激酶的抑制剂,并且敲除高代数MSC中的p21会增强MSC增殖能力[60, 61]。
骨髓MSC在培养到第9代时,就出现80%的SA-gal阳性细胞,即80%的MSC已经衰老了[35]。另一个实验室在培养牙髓MSC在传代10-11时出现约40%的SA-gal阳性MSC[19]。传代相关衰老的差异可能归因于不同的细胞培养系统[62, 63]。此外,高代数的MSC能触动更多的即时血液介导的炎症反应[64]并激活补体途径[64, 65],限制了它们在体内的存活和发挥功能。
衰老的MSC经历了明显的遗传和表观遗传变化[66-69]。大量证据表明miRNAs在调节干细胞功能中起重要作用[70]。干细胞的衰老也与miRNAs表达失调有关,已发现miR-335和miR-195在骨髓MSC衰老中起关键作用,改变它们的表达可以逆转MSCs的治疗效果[71, 72]。有两项研究通过微阵列或定量PCR方法证明了长期培养的骨髓MSC,会出现衰老相关miRNA表达谱的改变[35, 73]。对人脐带MSC和脐血MSC早期(P4代)和晚期(P11代)传代的microRNA图谱分析表明,来自脐带血和脐带血的MSC的衰老机制可能不同[74]。高代数(P13-P22)MSC分泌的微囊泡(MVs)(<500 nm)小于低代数(P3-P7)MSC,伴随CD105+MSC-MVs减少和miR-146a-5p增加[75]。
4
MSC的免疫调控能力
一些综述已经阐述了MSC和免疫细胞之间相互作用的可能机制[83-87]。MSC具有强大的免疫抑制潜力,这与剂量呈正相关,然而,工业化的大规模培养的MSC在3期试验中却未能有效治疗激素难治性急性GVHD[88]。一篇综述分析了可能原因:供体差异,表观遗传重编程,免疫原性和冷冻保存[89]。另一项关于MSC治疗激素难治性GVHD的系统综述和meta分析发现,MSC单次治疗后6个月的存活率为63%,并且与患者的年龄、MSCs培养液或提供的MSCs剂量没有差异[90]。但即使MSC具有强大的免疫调节潜能,MSC在GVHD的3期临床失败的原因仍需深入研究和调查。
长期培养是否损害了MSC的免疫调节功能?目前的研究结果并不一致。基于体外实验,MSC的免疫抑制作用从第2代到第7代没有明显区别[91]。也有研究发现人脐带MSC从第4代到第9代之间的免疫调节功能有下降的趋势[92]。有争议的是,第15代人脐带MSC的抑制活性高于第3代[93]。然而,在抗药性GVHD患者中,接受健康捐赠者低代数MSC(P1-2)的患者1年生存率为75%,而使用高代数MSC(P3-4)的患者1年生存率为仅21%[94]。长期培养(从P3到P7)对大鼠骨髓MSC的免疫豁免没有任何明显的影响[95]。
有研究提示,脐带和羊膜来源的MSC的免疫调节能力明显优于骨髓和脐血来源[96]。脂肪MSC的免疫调节能力也明显优于骨髓MSC[97-99]。然而,近的一项研究表明,脂肪MSC显示出比来自相同供体的骨髓MSC略高的免疫抑制能力,但是没有统计学差异[100]。这一结果与小鼠实验一致,即来源于同一个小鼠的脂肪MSC和骨髓MSCs在抑制T细胞增殖的免疫抑制能力上没有差异[101]。有趣的是,MSC的免疫调节能力和自身的增殖潜力之间没有明显的关系[13, 102]。
因此,我们需要明确影响MSC免疫抑制能力的因素,然后选择免疫抑制能力强的MSC用于免疫性疾病的治疗。
5
MSC与炎症环境
6
输注后MSC的体内分布
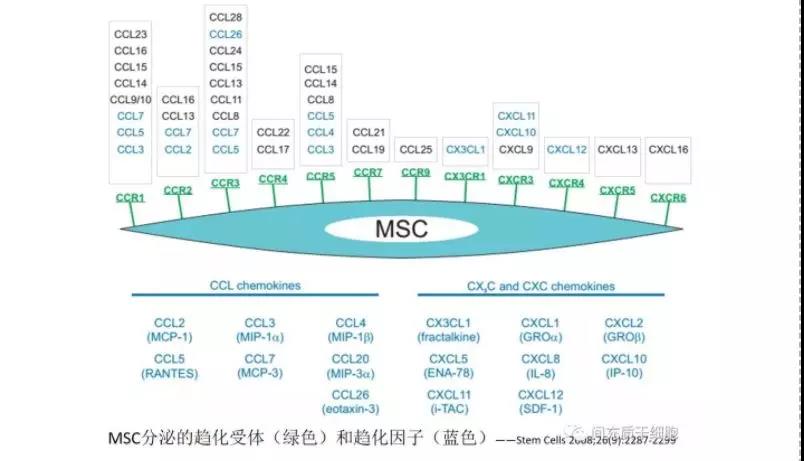
7
MSC的治疗方案
8
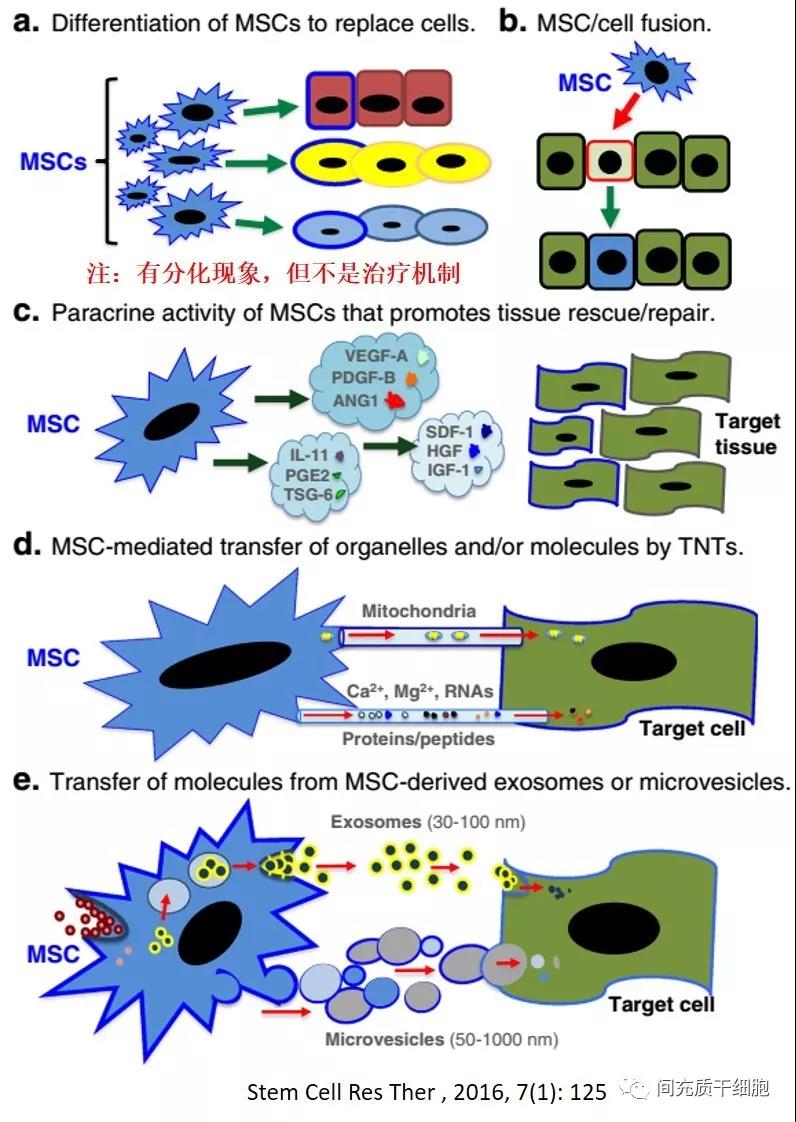
MSC的治疗机制
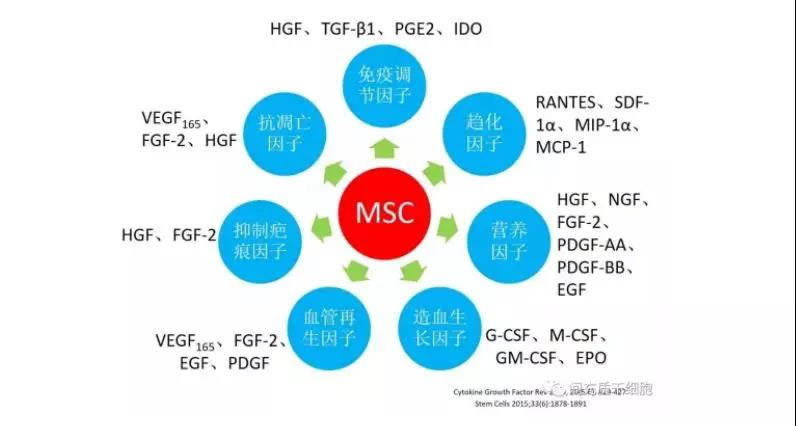
绝大多数输入的MSC并不能长期存活,这也是MSC安全性的一个重要原因,而且MSC的治疗机制是由于分泌的可溶性因子[13, 188-192]。
例如,改善心力衰竭的VEGF[193],HGF用于多发性硬化症[194]和肝脏疾病[195, 196],IGF-1和EGF用于伤口修复[197]。这些因子通过减少炎症和减少组织细胞的凋亡或通过刺激组织内源性干细胞的增殖和分化来增强受损组织的修复[198-201]。此外,MSC通过分泌营养分子来支持造血,包括细胞因子和生长因子[202-204],这已被动物模型实验所证实[198, 205-207]。基于体内动态分布,MSC更有可能通过“触摸即走(touch and go)”[83]或“击中即跑(hit and run)”[191]机制发挥其治疗作用,在迁移到受损器官后,MSC分泌应激诱导的治疗分子或直接与靶细胞相互作用,然后被机体清除。
9
健康人和患者MSC
10
总结和展望